Tratamentos
O tratamento para a Amiloidose TTR se desdobra em três aspectos: tratamento dos sintomas e sequelas, tratamento da doença propriamente dita e prevenção à transmissão da doença para os filhos.Tratamento e acompanhamento dos sintomas e sequelas
Por ser uma doença multissistêmica, isto é, que atinge vários órgãos e sistemas, o acompanhamento e tratamento dos sintomas requer uma equipe multidisciplinar, que envolva neurologistas, gastroenterologistas, oftalmologistas, urologistas, nutricionistas, cardiologistas, nefrologistas, psicólogos, dermatologistas, ortopedista, fisiatras, entre outros, de preferência que tenham conhecimentos específicos sobre essa doença.
No acompanhamento são utilizados exames de condução nervosa (eletroneuromiografia) para monitorar a polineuropatia, assim como eletrocardiografia, ecocardiografia e holter para a cardiomiopatia, entre outros.
Exames de sangue constantes servem para monitorar o estado geral do paciente. Exames de função renal e oftalmológicos também são considerados.
Consulte aqui os centros de referência para diagnóstico, acompanhamento e tratamento da Amiloidose TTR.
Tratamentos da Amiloidose TTR
O diagnóstico precoce é de fundamental importância, pois os tratamentos não curam as lesões preexistentes.
Um documento muito importante foi publicado em 2016, o Consenso Europeu sobre a Amiloidose Hereditátia TTR, que indica os tratamentos mais adequados aos perfis dos pacientes, e você pode acessar aqui.
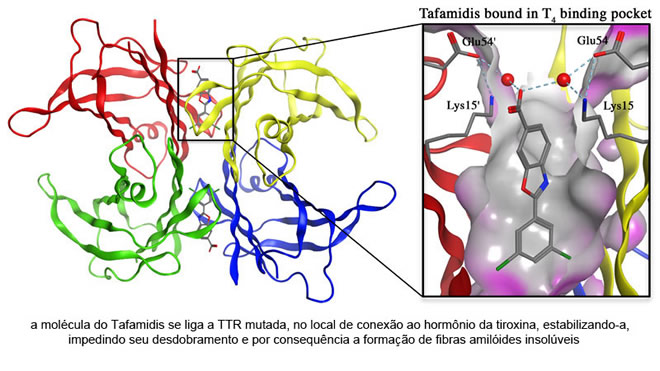
Tafamidis meglumina (20mg)
Nas últimas décadas, começaram a ser estudadas novas formas terapêuticas para a Amiloidose Hereditária, como a estabilização da TTR, inibição da produção da TTR, destruição das fibras amiloides insolúveis e inibição de sua agregação.
Desde a década de 90, o Dr. Jeffery W. Kelly estuda o mecanismo de como as proteínas se desagregam e formam fibras amilóides, e o que fazer para barrar esse processo. Kelly desenvolveu o medicamento Tafamidis, que age estabilizando a TTR anormal (mutada), evitando que se formem os depósitos de fibras amilóides e diminuindo assim a progressão da doença. Em 2006 recebeu o status de droga órfã pelo FDA e o EMA. O estudo com o medicamento foi conduzido em 2007 e seus resultados você pode acessar aqui.
Em novembro de 2011 a droga foi aprovada para comercialização pela Agência Europeia de Medicamentos (EMA) como o primeiro remédio para tratamento da Amiloidose Hereditária do mundo.
O medicamento é uma cápsula de uso oral, uma vez ao dia. É indicado para pacientes com Amiloidose Heditária TTR não submetidos ao transplante de fígado com estágio 1 da polineuropatia.
Em novembro de 2016 obteve o seu registro no Brasil (Anvisa). Em janeiro de 2018 o CONITEC incorporou o Tafamidis à lista de medicamentos de alto custo do SUS e em outubro de 2018 foi publicado o Protocolo Clínico e Diretrizes Terapêuticas (PCDT) que indica como o deve ser realizado o diagnóstico, acompanhamento e tratamento dos pacientes e a distribuição do medicamento foi iniciada em outubro de 2019.
Tafamidis (61mg)
O medicamento é uma cápsula de uso oral e deve ser tomada uma vez ao dia. 80mg de Tafamidis meglumina equivalem a 61mg de Tafamidis.
Foi aprovado nos EUA pela FDA para o tratamento da amiloidose cardíaca selvagem e hereditária TTR. No Brasil foi solicitado registro na Anvisa, que deve sair nos próximos meses.
Inotersen (inotersena nonadecassódica)
O fármaco Inotersen é um oligonucleotídeo antisense desenvolvido para o tratamento da amiloidose hereditária por TTR, para pacientes com quadro de polineuropatia. Ele atua interferindo no RNA mensageiro das células hepáticas, inibindo a produção da proteína transtirretina (TTR) que causa da doença. Clique aqui para ver o vídeo que explica o mecanismo de ação do medicamento.
O laboratório finalizou a fase III da pesquisa clínica multicêntrica internacional em meados de 2017. Os resultados da pesquisa foram divulgados no New England Journal of Medicine (acesse aqui) e o medicamento demonstrou ter alto potencial para tratar a doença, com perfil satisfatório de segurança, afim de retardar a progressão da doença e proporcionar mais qualidade de vida.
Foi aprovado no Brasil pela Anvisa em 29 de outubro de 2.019 para tratamento de pacientes adultos com Amiloidose Hereditária TTR com polineuropatia nos estágios 1 e 2. É aprovado também nos EUA, Europa e Canadá.
É uma injeção subcutânea onde o próprio paciente ou seu cuidador pode aplicar em casa, uma vez por semana. É obrigatório o acompanhamento do paciente para monitorização da função renal, hepática e das plaquetas quando tratado com Inotersen.
Patisiran (patisirana sódica)
O fármaco Patisiran é um RNA interference desenvolvido para o tratamento da amiloidose hereditária por TTR, para pacientes que possuem quadro de polineuropatia. Ele atua interferindo no RNA mensageiro das células hepáticas, inibindo a produção da proteína transtirretina (TTR) que causa da doença. Clique aqui para ver o vídeo que explica o medicanismo de ação do medicamento.
O laboratório finalizou a fase III da pesquisa clínica APOLLO multicêntrica internacional em meados de 2017. Os resultados da pesquisa foram divulgados no New England Journal of Medicine (acesse aqui) e o medicamento demonstrou ter alto potencial para tratar a doença, com perfil satisfatório de segurança.
(Os Drs. Andrew Z. Fire e Craig C. Mello ganharam o Prêmio Nobel de Medicina em 2006 pela invenção desse método de silenciamento gênico.
É um medicamento administrado via infusão, uma vez a cada 21 dias, com uso de pré-medicação.
Foi aprovado pela Anvisa em 16 de fevereiro de 2020 para tratamento de pacientes adultos Amiloidose Hereditária TTR com polineuropatia em estágios 1 e 2. É aprovado também nos Estados Unidos, Europa, Canadá, Japão e Suíça.
Está sendo conduzido estudo nomeado Apollo B para estender a indicação desse tratamento para a cardiomiopatia causada pela Amiloidose TTR.
Diflunisal
O diflunisal é um medicamento da classe dos anti-inflamatórios não esteróides, utilizado no alívio sintomático da inflamação e da dor. Sua molécula age como estabilizadora da proteína TTR (transtirretina) e sua segurança e eficácia foi demonstrada em estudo duplo-cego fase 2/3 em 2013. Acesse o estudo aqui
Como não foi solicitado registro ou autorização de comercialização para tratamento da Amiloidose Hereditária, só pode ser prescrito off-label o que trás restrições para disponibilização a população em larga escala, entretanto pode ser importado para uso individual. É utilizado por pacientes que não tem acesso a nenhum dos outros tratamentos e o paciente deve ser avaliado previamente para saber se pode usar esse tratamento (função renal).
O medicamento é uma capsula de uso oral e deve ser tomado duas vezes ao dia a dose de 250mg.
O Transplante Hepático
Trata-se de uma cirurgia extremamente invasiva e de alta complexidade, que traz risco de morte, intercorrências médicas e morbidade.
Para evitar a rejeição do novo órgão é necessário tomar remédios imunossupressores pelo resto da vida. Estes possuem diversos efeitos colaterais e tornam o paciente mais vulnerável a infecções.
O transplante não impede os problemas oculares. Além disso, podem ocorrer em grande parte dos doentes, complicações cardíacas com o passar dos anos. A função renal pode ser afetada com o tempo devido ao uso dos imunossupressores aliada a infiltração de amiloide nos rins. Observa-se também casos em que o transplante não se mostrou eficaz em travar a doença. Não é eficaz em evitar os problemas a longo prazo no sistema nervoso central. Existem diversos artigos publicados neste sentido, daí a necessidade de se desenvolver outras formas terapêuticas para a Amiloidose Hereditária.
Em casos de doença muito evoluída, não há benefício com o transplante, uma vez que as graves lesões já estabelecidas nos diversos órgãos afetam a recuperação do paciente. Esta é a razão pela qual se opta hoje pelo transplante nas fases iniciais da doença.
É recomendado sobretudo para pacientes com menos de 50 anos de idade, em estágio inicial (estágio 1), sem disfunção importante cardíaca ou renal ou baixo índice de massa corporal e mutação Val30Met (Val50Met)
A fila de espera de transplante de fígado é dividida pela compatibilidade dos grupos sanguíneos e ordenada pela gravidade da doença, de acordo com o índice MELD (fórmula matemática que possui variáveis relacionadas às alterações que as doenças hepáticas causam no sangue, resultando num valor). Quanto maior esse índice, maior a gravidade da doença e mais próximo do início da fila o paciente está.
Como o fígado do portador da Amiloidose Hereditária tem estrutura e funcionamento normal, e também é doado para outro doente, foi instituída uma situação especial para o portador de Amiloidose Hereditária em lista de espera, com MELD igual a 29. Isto o coloca numa posição privilegiada na fila, com chances de receber um órgão em pouco tempo, evitando assim a progressão da doença e suas sequelas. Cada estado possui uma lista de espera.
Impedindo a transmissão da doença - Fertilização assistida
É importante que todo paciente que esteja sob suspeita ou saiba ser portador da mutação tenha acesso ao aconselhamento genético, a fim de definir o risco de transmissão da doença aos seus descendentes. No Brasil já está disponível o método de fertilização in vitro, no qual somente os embriões livres do gene da Amiloidose Hereditária são implantados na mãe.
A primeira fertilização in vitro com diagnóstico genético pré-implantacional para a Amiloidose Hereditária foi realizada no Brasil, em 2009, pelo casal Paula de Melo Bittencourt e André Luiz Gonçalves Bittencourt, portador da Amiloidose Hereditária e transplantado. O procedimento foi executado no IPGO - Instituto Paulista de Ginecologia, Obstetrícia e Medicina Reprodutiva e o responsável pelo tratamento foi o ginecologista e especialista em reprodução humana Arnaldo Cambiaghi.
O diagnóstico genético pré-implantacional foi realizado por uma pesquisadora da Universidade de Campinas e o fato foi amplamente divulgado na mídia nacional, sendo veiculado em TVs e jornais.
Hoje o IPGO é o centro de referência de fertilização in vitro com diagnóstico genético pré-implantacional para Amiloidose Hereditária .
« Voltar